| |
| Med Sci (Paris). 2009 November; 25(11): 903–906. Published online 2009 November 15. doi: 10.1051/medsci/20092511903.Harmonine est un composant de la machinerie de mécanotransduction auditive Nicolas Grillet* Ulrich Müller Laboratory, The Scripps Research Institute, 10550 North Torrey Pines road, 92037, La Jolla, Californie, États-Unis MeSH keywords: Protéines adaptatrices de la transduction du signal, Cadhérines, Oreille interne, Ouïe, Humains |
La mécanotransduction, c’est-à-dire la transformation d’une force mécanique en un signal électrochimique, permet aux organismes vivants de percevoir différentes informations sensorielles émanant de l’organisme lui-même ou de son environnement. Chez l’homme, cela permet de détecter notamment les accélérations, les rotations, l’état de contraction musculaire ou bien encore les textures ou même les sons. |
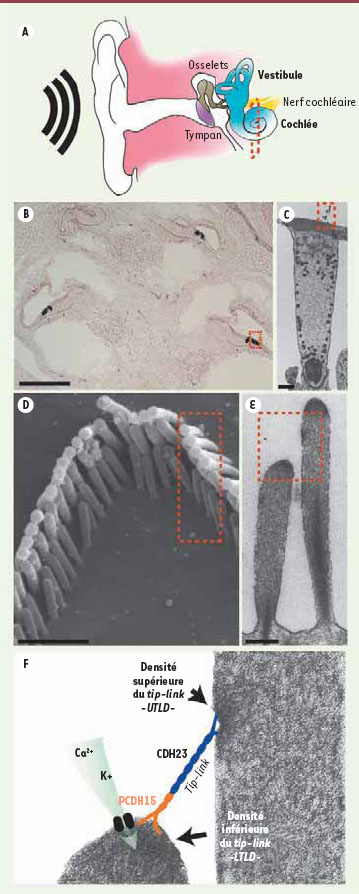
Organisation des cellules ciliées de l’oreille interne Dans l’oreille interne des vertébrés (Figure 1A), les cellules mécanoréceptrices spécialisées dans la détection des mouvements de la tête et des sons sont les cellules ciliées (Figure 1B). Chaque cellule ciliée se caractérise par la présence, à sa surface apicale, de rangées de protrusions membranaires remplies de filaments d’actine appelées stéréocils (Figure 1C-E). Ces derniers constituent l’organite de mécanotransduction des cellules ciliées. Les stéréocils sont remarquablement agencés en rangées de hauteur croissante et forment un faisceau cohérent. Ils sont interconnectés par différents types de filaments nanométriques, pour la plupart nécessaires à la formation et à la stabilisation de la structure [
1]. Un lien particulier, appelé tip-link, relie le sommet de chaque cil à son voisin de taille supérieure (Figure 1F). Lors d’une stimulation sonore, l’ensemble du faisceau de stéréocils s’incline de quelques nanomètres, ce qui induit l’accumulation de tension dans le tip-link et conduit, au-delà d’un seuil, à l’ouverture mécanique d’un canal cationique à large conductance. Ces canaux de mécanotransduction - qui ne sont toujours pas identifiés - sont localisés au sommet des stéréocils, à l’exception de ceux de la rangée la plus haute [
2]. À l’échelle de l’ensemble du faisceau stérérociliaire, ces flux ioniques individuels sont synchronisés et s’additionnent pour conduire à la libération de neurotransmetteur sur les neurones post-synaptiques qui transmettront l’information sensorielle sonore jusqu’au cerveau. Les cellules ciliées génèrent donc le signal électrique primaire de l’audition.  | Figure 1.
La mécanotransduction auditive des vertébrés. Les cadres en pointillés rouges indiquent la localisation du grossissement suivant. A. Les ondes sonores entrent par le canal auditif de l’oreille externe et font vibrer la membrane tympanique (violet). Ces vibrations sont répercutées et amplifiées par une chaîne d’osselets jusqu’à l’oreille interne. L’oreille interne est composée du vestibule, l’organe de l’équilibre (canaux semi-circulaires, utricule et saccule) et de la cochlée, l’organe de l’audition, qui forme une structure tubulaire spiralée. Le nerf cochléaire contient les fibres nerveuses qui relient la structure au cerveau. La cochlée est un complexe de canaux remplis de liquide en circuit fermé, au milieu duquel se loge l’épithélium sensoriel (l’organe de Corti). La pression exercée par les osselets sur cet ensemble génère des vagues qui stimulent mécaniquement les cellules ciliées. B. Les cellules ciliées sont ici colorées en bleu (tête de flèche et carré rouge) par hybridation in situ sur une coupe sagittale. C. Ces cellules sont allongées et présentent, à leur surface apicale, des protrusions d’actine recouvertes de membrane plasmique, les stéréocils (microscopie électronique à transmission [MET]). D. Le faisceau de stéréocils est organisé en rangées de hauteur croissante, intimement connectées les unes aux autres. E. Sur cette coupe sagittale observée par MET, on peut distinguer des densités au sommet des stéréocils ainsi qu’au dessous de ces derniers. F. Un grossissement plus important est présenté et complété par une représentation schématique de l’appareil de mécanotransduction auditive, avec le tip-link (150-200 nm) composé des cadhérines PCDH15 et CDH23, qui s’insèrent dans la membrane stéréociliaire au niveau des densités inférieure et supérieure, respectivement. Le tip-link n’est pas visible dans cette expérience. Le canal de mécanotransduction se localise au sommet des stéréocils de taille inférieure, et permet une entrée très rapide de calcium et de potassium dans le stéréocil lors d’une déflexion du faisceau de stéréocils. Ce flux ionique conduira à la dépolarisation de la cellule ciliée. Barres d’échelle : B, 200 μm ; C, 2 μm ; D, 1 μm ; E, 200 nm. Toutes les images ont été générées par N. Grillet à l’exception de l’image D (M. Schwander/N. Grillet). |
|
Harmonine est un composant de la densité supérieure du tip-link
La composition moléculaire de la machinerie de mécanotransduction auditive reste en grande partie méconnue car son exploration est particulièrement difficile : au niveau cellulaire, les cellules sont fragiles, ne régénèrent pas et sont peu accessibles, et, au niveau moléculaire, les composants à identifier sont présents en très faible quantité. Ainsi, ce n’est que récemment que la composition du tip-link a pu être élucidée. Le tip-link se compose de deux molécules d’adhésion de la famille des cadhérines, la cadhérine 23 (CDH23) et la protocadhérine 15 (PCDH15), chacune présente sous une forme homodimèrique ; elles s’associent par leur extrémité amino-terminale dans le milieu extracellulaire [
3,
4]. Le tip-link est donc intrinsèquement une structure asymétrique, composée dans sa partie inférieure de PCDH15, et dans sa partie haute de CDH23 (Figure 1F) [4]. Chacune des extrémités du tip-link est ancrée dans la membrane stérérociliaire au niveau de plaques apparaissant denses en microscopie électronique à transmission (MET). Ces densités sont idéalement placées pour contenir d’autres éléments de la machinerie de mécanotransduction auditive. Afin d’identifier les constituants moléculaires de cette machinerie, notre laboratoire s’est intéressé aux partenaires cytoplasmiques des composants du tip-link, et notamment à ceux de CDH23 qui s’insère dans la densité supérieure du tip-link (UTLD pour upper tip-link density) (Figure 1F). Ce travail s’est focalisé sur un candidat idéal, la protéine Harmonine. Nous avons été guidés par le fait que, chez l’homme, des mutations dans les gènes codant pour CDH23, PCDH15 ou Harmonine entraînent un tableau clinique similaire, caractérisé par une surdité profonde associée à une cécité progressive (syndrome de Husher) [1,
5]. Harmonine est une protéine cytoplasmique d’échafaudage composée de différents domaines d’interaction protéique. Dans sa forme la plus longue, Harmonine possède trois domaines PDZ1, deux répétitions coiled-coil et un domaine riche en proline-sérine-thréonine (PST) (Figure 2A) [
6]. De plus, cette protéine qui a été caractérisée comme pouvant interagir in vitro avec PCDH15 et CDH23, est présente à proximité du tip-link au cours du développement du faisceau stéréociliaire [
7–
10]. Afin de tester si Harmonine est un authentique composant de la machinerie de mécanotransduction, nous avons tout d’abord entrepris une analyse de sa localisation au sein du faisceau stéréociliaire adulte, en utilisant la résolution la plus élevée possible par MET. De nouveaux anticorps dirigés contre Harmonine ont été détectés grâce à leur couplage à des billes d’or, opaques au faisceau d’électron [
11]. Cette analyse a montré une concentration des billes au niveau de la densité supérieure du tiplink, suggérant que Harmonine en est un composant. La distribution asymétrique d’Harmonine à une extrémité du tip-link est une réminiscence de celle de CDH23. Pour déterminer si une interaction avec CDH23 est requise in vivo pour la localisation d’Harmonine au niveau de l’UTLD, nous avons généré une souris génétiquement modifiée où la séquence codante du deuxième domaine PDZ d’Harmonine a été changée, annihilant l’interaction avec CDH23 in vitro. Ces animaux sont sourds à 4 semaines, et présentent un faisceau de stéréocils quelque peu déstructuré, indiquant un rôle d’Harmonine lors du développement du faisceau. Néanmoins la localisation d’Harmonine peut être étudiée chez ce mutant : Harmonine n’est plus concentrée dans l’UTLD, mais elle est distribuée de manière diffuse dans le stéréocil, comme chez les souris mutantes pour CDH23 [10, 11]. Cela suggère que Harmonine et CDH23 agissent de concert dans les stéréocils.  | Figure 2.
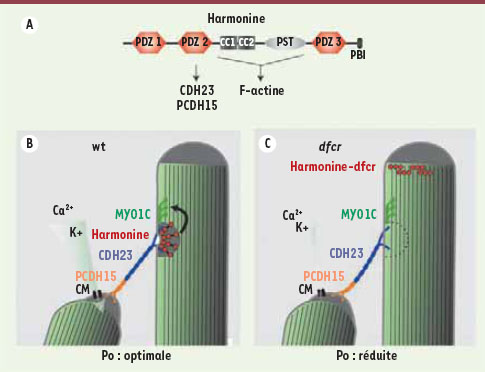
Harmonine est nécessaire pour une sensibilité mécanique optimale des stéréocils. A. Harmonine est une molécule cytoplasmique d’échafaudage composée de différents domaines d’interaction protéique. Dans sa forme la plus longue, elle possède trois domaines PDZ, deux domaines coiled-coil (CC) ainsi qu’un domaine riche en proline/sérine/thréonine (PST). Le domaine PDZ2 permet une interaction in vitro avec PCDH15 et CDH23 ; l’ensemble des domaines CC et PST permet une liaison (directe ou indirecte) avec les filaments d’actine. B. Modèle de mécanotransduction cochléaire chez une souris sauvage (wt). Harmonine se localise au niveau de la densité supérieure du tip-link. Dans cette position, elle peut interagir à la fois avec le tip-link (CDH23) et le cytosquelette d’actine. Une machinerie d’adaptation (supposée faire intervenir des moteurs de myosines tels que la myosine 1c (MYO1C) maintient une tension optimale dans l’ensemble du système et induit une probabilité d’ouverture des canaux mécanosensibles (CM) optimale, proche de leur plus grande sensibilité au déplacement. C. Dans le contexte mutant dfcr, les domaines CC et PST d’Harmonine sont absents de la protéine. Harmonine se localise alors non plus au UTLD mais au sommet du stéréocil. La structure dense aux électrons de l’ UTLD est absente, ainsi que l’indentation locale de la membrane. La mesure de la probabilité d’ouverture (Po) des canaux par rapport au déplacement mécanique montre une sensibilité diminuée avec une Po réduite. Ces observations sont compatibles avec une diminution de la force transmise depuis la partie supérieure du tip-link jusqu’au canal mécanosensible, représentée ici par une légère relaxation du tip-link. La fonction d’Harmonine pourrait être d’organiser d’autres composants cytoplasmiques autour de CDH23 et de la membrane plasmique locale, afin d’optimiser la réponse de la machinerie mécanosensible à la tension. B-C. Adaptation de la figure 7 de [ 11] (avec l’aimable autorisation de Neuron). |
La machinerie de mécanotransduction des cellules ciliées est supposée être reliée au cytosquelette d’actine des stéréocils pour permettre un ancrage solide et donc sa mise sous tension. Nous nous sommes demandés si Harmonine pouvait constituer le lien entre le tip-link (CDH23) et le cytosquelette d’actine du stéréocil. Les domaines coiled-coil et PST d’Harmonine permettent, en effet, une association in vitro avec les filaments d’actine [
8, 11]. Les souris déficientes pour ces domaines, appelées dfcr (deaf circler), sont sourdes mais les stéréocils des cellules ciliées cochléaires sont assemblés correctement en faisceau. La localisation d’Harmonine est cependant affectée puisque la protéine mutante s’accumule au sommet des stéréocils [11]. Une analyse par MET a pu montrer que, dans les souris dfcr, la densité supérieure du tip-link était totalement absente alors que la densité inférieure persistait. Ces résultats permettent d’affirmer qu’Harmonine non seulement est un composant de l’UTLD, mais est aussi requise pour la formation et/ou la stabilité de cette structure. |
Conséquences de l’absence d’harmonine sur le processus de mécanotransduction Avec leur faisceau de stéréocils structuré correctement, les souris dfcr constituent un modèle idéal pour analyser les conséquences physiologiques de l’absence d’Harmonine au niveau du tip-link sur le processus de mécanotransduction. Les études électrophysiologiques de ce mutant ont démontré :
-
d’une part une réduction de la sensibilité mécanique : il faut déplacer le faisceau de stéréocils environ deux fois plus dans les souris dfcr que dans les sauvages pour ouvrir un nombre similaire de canaux mécanosensibles [11],
-
d’autre part, une réduction de la cinétique d’inactivation du canal, aussi bien dans sa composante rapide (inactivation directe ou indirecte du canal de manière dépendante du calcium) que lente (reflétant un glissement de la partie supérieure de la machinerie de mécanotransduction sur les filaments d’actine via des moteurs de myosine, diminuant la tension dans l’ensemble du système).
Ces résultats sont largement cohérents avec un modèle dans lequel l’absence d’Harmonine induit une relaxation globale de l’appareil de mécanotransduction : l’ancrage supérieur du tip-link au cytosquelette est réduit entraînant une diminution de la tension dans le système, cette perte de tension se répercutant jusqu’au canal de mécanotransduction par l’intermédiaire du tip-link. Cela engendre de facto une diminution de la probabilité d’ouverture du canal (Figure 2B-C). La fonction d’Harmonine pourrait être d’organiser d’autres composants cytoplasmiques autour de CDH23 et de la membrane plasmique locale, afin d’optimiser la réponse de la machinerie mécanosensible à la tension et donc à la détection des ondes sonores. Ce travail identifie Harmonine comme un authentique élément de la machinerie de mécanotransduction des cellules ciliées cochléaires. |
L’auteur déclare n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
L’auteur tient à remercier tout le personnel du laboratoire du Dr Müller, ainsi que Dr B. Coste et Dr S. Grillet pour leurs commentaires pertinents sur le manuscrit.
|
Footnotes |
1. El-Amraoui A, Lefevre G, Hardelin JP, et al. Syndrome de Usher de type 1 et développement de la touffe ciliaire des cellules sensorielles de l’oreille interne. Med Sci (Paris) 2005; 21 : 737–40. 2. Beurg M, Fettiplace R, Nam JH, et al. and Localization of inner hair cell mechanotransducer channels using high-speed calcium imaging. Nat Neurosci 2009; 12 : 553–8. 3. Siemens J, Lillo C, Dumont RA, et al. and Cadherin 23 is a component of the tip link in hair-cell stereocilia. Nature 2004; 428 : 950–5. 4. Kazmierczak P, Sakaguchi H, Tokita J, et al. Cadherin 23 and protocadherin 15 interact to form tip-link filaments in sensory hair cells. Nature 2007; 449 : 87–91. 5. Verpy E, Leibovici M, Zwaenepoel I, et al. A defect in harmonin, a PDZ domain-containing protein expressed in the inner ear sensory hair cells, underlies Usher syndrome type 1C. Nat Genet 2000; 26 : 51–5. 6. Gilgenkrantz S. Harmonine, un joli nom pour une protéine impliquée dans un des syndromes de Usher. Med Sci (Paris) 2001; 17 : 379–380. 7. Adato A, Michel V, Kikkawa Y, et al. Interactions in the network of Usher syndrome type 1 proteins. Hum Mol Genet 2005; 14 : 347–56. 8. Boeda B, El-Amraoui A, Bahloul A, et al. and Myosin VIIa, harmonin and cadherin 23, three Usher I gene products that cooperate to shape the sensory hair cell bundle. EMBO J 2002; 21 : 6689–99. 9. Siemens J, Kazmierczak P, Reynolds A, et al. The Usher syndrome proteins cadherin 23 and harmonin form a complex by means of PDZ-domain interactions. Proc Natl Acad Sci USA 2002; 99 : 14946–51. 10. Lefevre G, Michel V, Weil D, et al. A core cochlear phenotype in USH1 mouse mutants implicates fibrous links of the hair bundle in its cohesion, orientation and differential growth. Development 2008; 135 : 1427–37. 11. Grillet N, Xiong W, Reynolds A, et al. Harmonin mutations cause mechanotransduction defects in cochlear hair cells. Neuron 2009; 62 : 375–87. |